در مطلب قبل به بحث وزن اتمي و ايزوتوپ ها رسيديم و چند سوال مطرح شد. حال براي اين كه آموخته هاي خود را بيازماييد، با چند سوال ديگر اين بحث را شروع مي كنيم و راجع به ميانگين وزن اتمي بيش تر خواهيم آموخت.
سوال 1:
فرض كنيد دانشمندان تصميم مي گيرند تا سيستم جديد وزن اتمي را طراحي كنند كه در آن يك اتم 12C ديگر 12 amu وزن ندارد بلكه1.00 amu است. وزن يك اتم 16O در اين سيستم چه قدر خواهد بود؟
جواب: 16/12 = 1.33 amu
سوال 2:
كربن موجود در طبيعت داراي 99% ايزوتوپ 12C و 1% ايزوتوپ 13C است. اگر 99 اتم 12C و يك اتم 13C داشتيد، جرم 99 تا اتم 12C و 1 اتم 13C چه قدر خواهد بود؟
الف) 1188 amu و 13 amu
ب) 99 amu و 1 amu
ج) 1000 amu و 10 amu
جواب: گزينه الف صحيح است. 99 اتم 12C داراي جرم 99 x 12.00 = 1188 amu خواهد بود و جرم يك اتم 13C خواهد بود:
1 x 13 = 13 amu
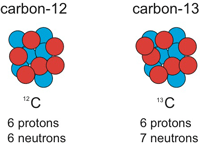
سوال3:
جرم ميانگين 100 اتم موجود در سوال 2 را تعيين كنيد.
جرم كل اين صد اتم :
1188 + 13 = 1201 amu
ميانگين جرم آن ها خواهد بود:
1201 amu/100 اتم =
12.01 amu ( براي هر اتم)
اگر نگاه گذرا به جدول تناوبي داشته باشيد، متوجه خواهيد شد جرم اتمي كربن 12.01 نوشته شده است. همچنين توجه كنيد كه براي جرم اتمي، واحدي وجود ندارد. شما در جدول تناوبي متوسط جرم اتمي براي تعداد زيادي ايزوتوپ را مشاهده مي كنيد.
سوال 4:
جرم اتمي آرگون كه داراي 3 ايزوتوپ طبيعي 38Ar, 36Ar و 40Ar است، چقدر است؟ درصد اين ايزوتوپ ها در طبيعت به ترتيب 0.34%، 0.07% و 99.58% است.
راهنمايي: بدون استفاده از ماشين حساب مي توانيد جواب را پيدا كنيد و بايستي از متوسط وزني استفاده كنيد.
الف) 33.33 ب) 38.00 ج) 39.98
جواب الف اشتباه است. اين گزينه، درصد متوسط را نشان مي دهد:
(0.34 + 0.07 + 99.58)/3
جواب ب نادرست است زيرا متوسط جرم هاي سه ايزوتوپ را در حالتي كه وزن هر سه مساوي است، نشان مي دهد.
جواب ج صحيح است. مي توانيد از درصدهاي كم ايزوتوپ هايي با عدد جرمي 36 و 38 اين نكته را بفهميد. يعني جرم بايد به عدد 40 خيلي نزديك باشد. در محاسبه، ايزوتوپ ها بايستي بر اساس درصدشان وزن شوند:
0.0034 x 36.00 + 0.0007 x 38.00 + 0.9958 x 40.00 = 39.98
سوال 5:
كلر داراي دو ايزوتوپ 35Cl با جرم 34.97 و 37Cl با جرم 36.95 است. وزن اتمي كلر 35.453 است. درصد هر ايزوتوپ چقدر است؟
جواب:
در اين سوال وزن اتمي مشخص است و وزن متوسط جرم هاي دو ايزوتوپ است اما درصد ايزوتوپ ها را نمي دانيد. به نظر مي رسد دو مجهول داريد. در واقع جمع درصد دو ايزوتوپ بايد 100باشد و براي همين اگر درصد 35Cl را x بگيريم، درصد 37Cl خواهد بود: 100 – x
اگر درصد ها را برداريم و با اعداد آن ها محاسبات را ادامه دهيم، خواهيم داشت
منبع:
- یکشنبه ۳۰ آذر ۹۹ ۱۲:۰۰ ۳۹ بازديد
- ۰ نظر